Definizione di teoria di Valence Bond (VB)
 Share
Share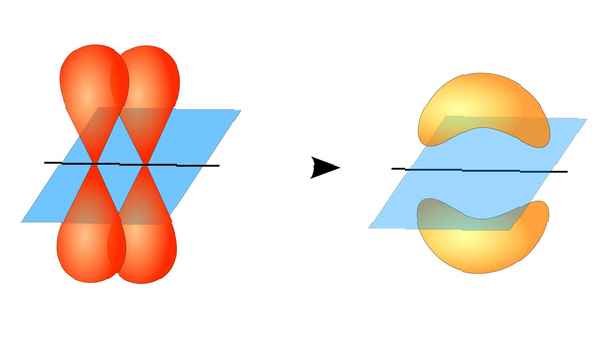
La teoria del legame di valenza (VB) è una teoria del legame chimico che spiega il legame chimico tra due atomi. Come la teoria dell'orbitale molecolare (MO), spiega il legame usando i principi della meccanica quantistica. Secondo la teoria del legame di valenza, il legame è causato dalla sovrapposizione di orbitali atomici riempiti per metà. I due atomi condividono l'elettrone spaiato tra loro per formare un orbitale riempito per formare un orbitale ibrido e legarsi insieme. I legami sigma e pi fanno parte della teoria dei legami di valenza.
Key Takeaways: Teoria di Valence Bond (VB)
- La teoria del legame di valenza o teoria del VB è una teoria basata sulla meccanica quantistica che spiega come funziona il legame chimico.
- Nella teoria del legame di valenza, gli orbitali atomici dei singoli atomi sono combinati per formare legami chimici.
- L'altra teoria principale del legame chimico è la teoria orbitale molecolare o teoria MO.
- La teoria del legame di valenza viene utilizzata per spiegare come si formano i legami chimici covalenti tra diverse molecole.
Teoria
La teoria del legame di valenza prevede la formazione covalente di legame tra atomi quando hanno orbitali atomici di valenza riempiti per metà, ciascuno contenente un singolo elettrone spaiato. Questi orbitali atomici si sovrappongono, quindi gli elettroni hanno la più alta probabilità di trovarsi all'interno della regione di legame. Entrambi gli atomi condividono quindi i singoli elettroni spaiati per formare orbitali debolmente accoppiati.
I due orbitali atomici non devono necessariamente essere uguali tra loro. Ad esempio, i legami sigma e pi possono sovrapporsi. I legami sigma si formano quando i due elettroni condivisi hanno orbitali che si sovrappongono testa a testa. Al contrario, i legami pi si formano quando gli orbitali si sovrappongono ma sono paralleli tra loro.
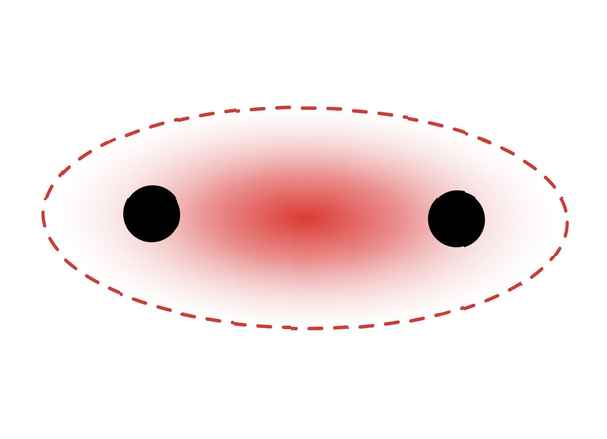 Questo diagramma raffigura un legame sigma tra due atomi. L'area rossa rappresenta la densità di elettroni localizzata. Licenza ZooFari / Creative Commons Attribution-Share Alike 3.0 Unported
Questo diagramma raffigura un legame sigma tra due atomi. L'area rossa rappresenta la densità di elettroni localizzata. Licenza ZooFari / Creative Commons Attribution-Share Alike 3.0 Unported I legami sigma si formano tra elettroni di due orbitali s poiché la forma orbitale è sferica. I legami singoli contengono un legame sigma. I doppi legami contengono un legame sigma e un legame pi. I legami tripli contengono un legame sigma e due legami pi. Quando si formano legami chimici tra atomi, gli orbitali atomici possono essere ibridi di legami sigma e pi.
La teoria aiuta a spiegare la formazione del legame nei casi in cui una struttura di Lewis non è in grado di descrivere un comportamento reale. In questo caso, diverse strutture di legame di valenza possono essere usate per descrivere una singola stenosi di Lewis.
Storia
La teoria del legame di valenza attinge dalle strutture di Lewis. G.N. Lewis propose queste strutture nel 1916, basandosi sull'idea che due elettroni di legame condiviso formavano legami chimici. La meccanica quantistica fu applicata per descrivere le proprietà di legame nella teoria di Heitler-Londra del 1927. Questa teoria descriveva la formazione di legame chimico tra gli atomi di idrogeno nella molecola H2 usando l'equazione delle onde di Schrödinger per unire le funzioni d'onda dei due atomi di idrogeno. Nel 1928, Linus Pauling combinò l'idea del legame di Lewis con la teoria di Heitler-Londra per proporre la teoria del legame di valenza. La teoria del legame di valenza è stata sviluppata per descrivere la risonanza e l'ibridazione orbitale. Nel 1931, Pauling pubblicò un articolo sulla teoria del legame di valenza intitolato "Sulla natura del legame chimico". I primi programmi informatici utilizzati per descrivere il legame chimico utilizzavano la teoria dell'orbitale molecolare, ma dagli anni '80 i principi della teoria del legame di valenza sono diventati programmabili. Oggi, le versioni moderne di queste teorie sono competitive l'una con l'altra in termini di descrizione accurata del comportamento reale.
usi
La teoria dei legami di valenza può spesso spiegare come si formano i legami covalenti. La molecola diatomica del fluoro, F2, è un esempio. Gli atomi di fluoro formano legami covalenti singoli tra loro. Il legame F-F risulta dalla sovrapposizione pz orbitali, che contengono ciascuno un singolo elettrone spaiato. Una situazione simile si verifica nell'idrogeno, H2, ma le lunghezze e la forza del legame sono diverse tra H2 e F2 molecole. Un legame covalente si forma tra idrogeno e fluoro in acido fluoridrico, HF. Questo legame si forma dalla sovrapposizione dell'idrogeno 1S orbitale e fluoro 2pz orbitale, che hanno ciascuno un elettrone spaiato. In HF, entrambi gli atomi di idrogeno e di fluoro condividono questi elettroni in un legame covalente.
fonti
- Cooper, David L .; Gerratt, Joseph; Raimondi, Mario (1986). "La struttura elettronica della molecola di benzene." Natura. 323 (6090): 699. doi: 10.1038 / 323699a0
- Messmer, Richard P .; Schultz, Peter A. (1987). "La struttura elettronica della molecola di benzene." Natura. 329 (6139): 492. doi: 10.1038 / 329492a0
- Murrell, J.N .; Kettle, S.F.A .; Tedder, J.M. (1985). Il legame chimico (2a edizione). John Wiley & Sons. ISBN 0-471-90759-6.
- Pauling, Linus (1987). "Struttura elettronica della molecola di benzene." Natura. 325 (6103): 396. doi: 10.1038 / 325396d0
- Shaik, Sason S .; Phillipe C. Hiberty (2008). Guida di un chimico alla teoria dei legami di Valence. New Jersey: Wiley-Interscience. ISBN 978-0-470-03735-5.
