Definizione di osmosi in chimica
 Share
Share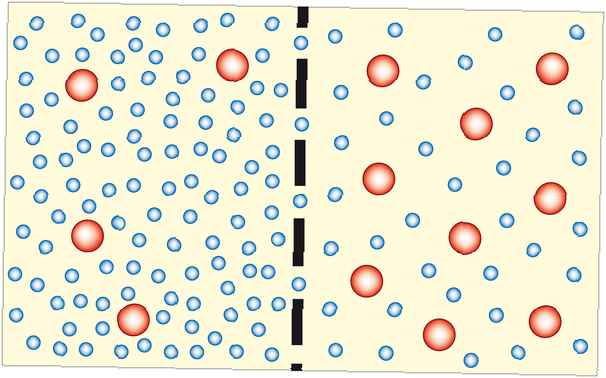
Due importanti processi di trasporto di massa in chimica e biologia sono la diffusione e l'osmosi.
Definizione di osmosi
Osmosi è il processo in cui le molecole di solvente si muovono attraverso una membrana semipermeabile da una soluzione diluita a una soluzione più concentrata (che diventa più diluita). Nella maggior parte dei casi, il solvente è acqua. Tuttavia, il solvente può essere un altro liquido o addirittura un gas. L'osmosi può essere fatta per funzionare.
Storia
Il fenomeno dell'osmosi fu i primi documenti nel 1748 di Jean-Antoine Nollet. Il termine "osmosi" fu coniato dal medico francese René Joachim Henri Dutrochet, che lo derivò dai termini "endosmose" ed "exosmose".
Come funziona l'osmosi
L'osmosi agisce per equalizzare la concentrazione su entrambi i lati di una membrana. Poiché le particelle di soluto non sono in grado di attraversare la membrana, è l'acqua (o altro solvente) che deve muoversi. Più il sistema si avvicina all'equilibrio, più stabile diventa, quindi l'osmosi è termodinamicamente favorevole.
Esempio di osmosi
Un buon esempio di osmosi si vede quando i globuli rossi vengono immessi in acqua dolce. La membrana cellulare dei globuli rossi è una membrana semipermeabile. La concentrazione di ioni e altre molecole di soluto è più alta all'interno della cellula che all'esterno, quindi l'acqua si sposta nella cellula attraverso l'osmosi. Questo fa gonfiare le cellule. Poiché la concentrazione non riesce a raggiungere l'equilibrio, la quantità di acqua che può muoversi nella cellula è moderata dalla pressione della membrana cellulare che agisce sul contenuto della cellula. Spesso, la cellula aspira più acqua di quella che la membrana può sostenere, provocando l'esplosione della cellula.
Un termine correlato è la pressione osmotica. La pressione osmotica è la pressione esterna che dovrebbe essere applicata in modo tale che non vi sia alcun movimento netto di solvente attraverso una membrana.
