Pressione osmotica e tonicità
 Share
Share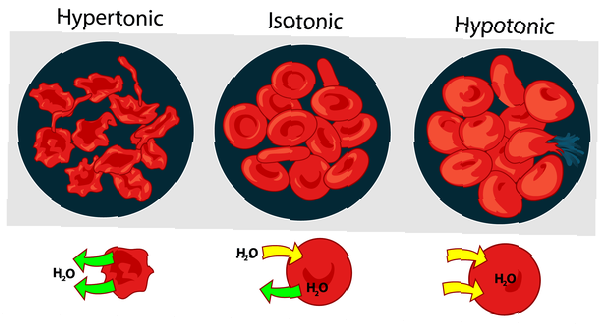
La pressione osmotica e la tonicità spesso creano confusione nelle persone. Entrambi sono termini scientifici relativi alla pressione. La pressione osmotica è la pressione di una soluzione contro una membrana semipermeabile per impedire all'acqua di fluire verso l'interno attraverso la membrana. La tonicità è la misura di questa pressione. Se la concentrazione di soluti su entrambi i lati della membrana è uguale, allora non vi è alcuna tendenza per l'acqua a muoversi attraverso la membrana e nessuna pressione osmotica. Le soluzioni sono isotoniche l'una rispetto all'altra. Di solito, c'è una maggiore concentrazione di soluti su un lato della membrana rispetto all'altro. Se non sei chiaro sulla pressione osmotica e sulla tonicità, potrebbe essere perché sei confuso su come la differenza tra diffusione e osmosi.
Diffusione contro osmosi
La diffusione è il movimento di particelle da una regione di concentrazione più elevata a una di concentrazione più bassa. Ad esempio, se aggiungi zucchero all'acqua, lo zucchero si diffonderà in tutta l'acqua fino a quando la concentrazione di zucchero nell'acqua non sarà costante in tutta la soluzione. Un altro esempio di diffusione è come il profumo del profumo si diffonde in una stanza.
Durante l'osmosi, come nella diffusione, vi è la tendenza delle particelle a cercare la stessa concentrazione in tutta la soluzione. Tuttavia, le particelle possono essere troppo grandi per attraversare una membrana semipermeabile che separa le regioni di una soluzione, quindi l'acqua si sposta attraverso la membrana. Se hai una soluzione di zucchero su un lato di una membrana semipermeabile e acqua pura sull'altro lato della membrana, ci sarà sempre una pressione sul lato dell'acqua della membrana per provare a diluire la soluzione di zucchero. Questo significa che tutta l'acqua scorrerà nella soluzione di zucchero? Probabilmente no, perché il fluido potrebbe esercitare una pressione sulla membrana, equalizzando la pressione.
Ad esempio, se metti una cellula in acqua dolce, l'acqua scorrerà nella cellula, facendola gonfiare. Tutta l'acqua scorrerà nella cella? No. O la cellula si romperà o altrimenti si gonfierà fino al punto in cui la pressione esercitata sulla membrana supera la pressione dell'acqua che prova ad entrare nella cellula.
Naturalmente, piccoli ioni e molecole possono essere in grado di attraversare una membrana semipermeabile, quindi soluti come piccoli ioni (Na+, Cl-) si comportano come farebbero se si verificasse una semplice diffusione.
Ipertonicità, isotonicità e ipotonia
La tonicità delle soluzioni l'una rispetto all'altra può essere espressa come ipertonica, isotonica o ipotonica. L'effetto di diverse concentrazioni di soluti esterni sui globuli rossi è un buon esempio per una soluzione ipertonica, isotonica e ipotonica.
Soluzione ipertonica o ipertonicità
Quando la pressione osmotica della soluzione al di fuori dei globuli rossi è superiore alla pressione osmotica all'interno dei globuli rossi, la soluzione è ipertonica. L'acqua all'interno delle cellule del sangue esce dalle cellule nel tentativo di equalizzare la pressione osmotica, causando il restringimento o la creazione delle cellule.
Soluzione isotonica o isotonicità
Quando la pressione osmotica all'esterno dei globuli rossi è uguale alla pressione all'interno delle cellule, la soluzione è isotonica rispetto al citoplasma. Questa è la solita condizione dei globuli rossi nel plasma.
Soluzione ipotonica o ipotonia
Quando la soluzione al di fuori dei globuli rossi ha una pressione osmotica inferiore rispetto al citoplasma dei globuli rossi, la soluzione è ipotonica rispetto alle cellule. Le cellule assorbono acqua nel tentativo di equalizzare la pressione osmotica, facendole gonfiare e potenzialmente esplodere.
