Definizione ed esempi di ioni spettatori
 Share
Share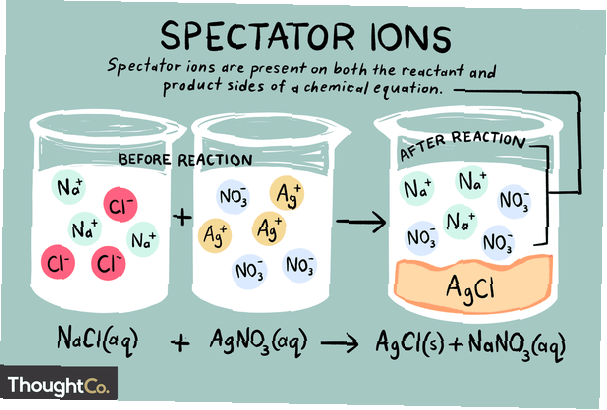
Gli ioni sono atomi o molecole che trasportano una carica elettrica netta. Esistono diversi tipi di ioni, inclusi cationi, anioni e ioni spettatori. Uno ione spettatore è uno che esiste nella stessa forma sia sul lato reagente che sul lato prodotto di una reazione chimica.
Definizione di ione spettatore
Gli ioni spettatori possono essere cationi (ioni con carica positiva) o anioni (ioni con carica negativa). Lo ione è invariato su entrambi i lati di un'equazione chimica e non influisce sull'equilibrio. Quando si scrive un'equazione ionica netta, gli ioni spettatore trovati nell'equazione originale vengono ignorati. Quindi, il totale la reazione ionica è diversa dalla netto reazione chimica.
Esempi di ioni spettatori
Considera la reazione tra cloruro di sodio (NaCl) e solfato di rame (CuSO4) in soluzione acquosa.
2 NaCl (aq) + CuSO4 (aq) → 2 Na+ (aq) + SO42- (aq) + CuCl2 (S)
La forma ionica di questa reazione è: 2 Na+ (aq) + 2 cl- (aq) + Cu2+ (aq) + SO42- (aq) → 2 Na+ (aq) + SO42- (aq) + CuCl2 (S)
Gli ioni sodio e ione solfato sono gli ioni spettatori in questa reazione. Sembrano invariati sia nel prodotto che nel lato reagente dell'equazione. Questi ioni "spettano" (guardano) mentre gli altri ioni formano il cloruro di rame. Gli ioni spettatore vengono cancellati da una reazione quando si scrive l'equazione ionica netta, quindi l'equazione ionica netta per questo esempio sarebbe:
2 cl- (aq) + Cu2+ (aq) → CuCl2 (S)
Sebbene gli ioni spettatore siano ignorati nella reazione netta, influenzano la lunghezza del Debye.
Tabella degli ioni spettatori comuni
Questi ioni sono ioni spettatori perché non reagiscono con l'acqua, quindi quando i composti solubili di questi ioni si dissolvono nell'acqua, non influenzano direttamente il pH e possono essere ignorati. Mentre puoi consultare un tavolo, vale la pena memorizzare gli ioni spettatori comuni perché conoscerli rende più facile identificare acidi forti, basi forti e sali neutri in una reazione chimica. Il modo più semplice per impararli è in gruppi di tre o trii di ioni trovati insieme nella tavola periodica degli elementi.
