Definizione ed equazione del pH in chimica
 Share
Share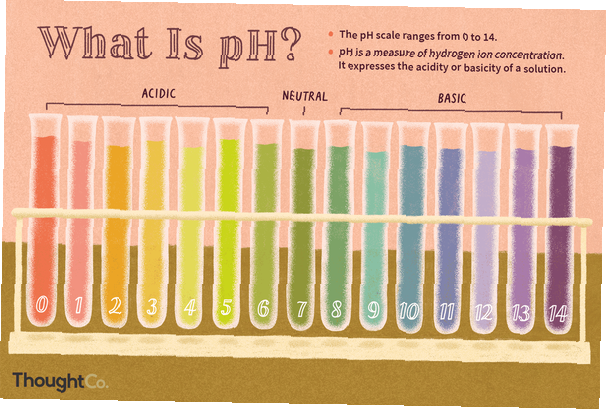
Il pH è una misura della concentrazione di ioni idrogeno, una misura dell'acidità o dell'alcalinità di una soluzione. La scala del pH varia generalmente da 0 a 14. Le soluzioni acquose a 25 ° C con un pH inferiore a 7 sono acide, mentre quelle con un pH maggiore di 7 sono basiche o alcaline. Un livello di pH di 7,0 a 25 ° C è definito "neutro" perché la concentrazione di H3O+ è uguale alla concentrazione di OH- in acqua pura. Gli acidi molto forti potrebbero avere un pH negativo, mentre le basi molto forti potrebbero avere un pH maggiore di 14.
equazione del pH
L'equazione per il calcolo del pH fu proposta nel 1909 dal biochimico danese Søren Peter Lauritz Sørensen:
pH = -log [H+]
dove log è il logaritmo in base 10 e [H+] indica la concentrazione di ioni idrogeno in unità di moli per litro di soluzione. Il termine "pH" deriva dalla parola tedesca "potenz", che significa "potenza", combinata con H, l'elemento simbolo dell'idrogeno, quindi pH è un'abbreviazione per "potenza dell'idrogeno".
Esempi di valori di pH di sostanze chimiche comuni
Lavoriamo ogni giorno con molti acidi (basso pH) e basi (alto pH). Esempi di valori di pH di prodotti chimici di laboratorio e prodotti per la casa includono:
0: acido cloridrico
2.0: succo di limone
2.2: aceto
4.0: vino
7.0: acqua pura (neutra)
7.4: sangue umano
13.0: liscivia
14.0: idrossido di sodio
Non tutti i liquidi hanno un valore pH
Il pH ha significato solo in una soluzione acquosa (in acqua). Molte sostanze chimiche, compresi i liquidi, non hanno valori di pH. Se non c'è acqua, non c'è pH. Ad esempio, non esiste un valore pH per olio vegetale, benzina o alcool puro.
IUPAC Definizione di pH
L'Unione internazionale di chimica pura e applicata (IUPAC) ha una scala di pH leggermente diversa che si basa su misurazioni elettrochimiche di una soluzione tampone standard. In sostanza, la definizione usa l'equazione:
pH = -log aH+
dove unH+ indica l'attività dell'idrogeno, che è la concentrazione effettiva di ioni idrogeno in una soluzione. Questo potrebbe essere leggermente diverso dalla vera concentrazione. La scala del pH IUPAC include anche fattori termodinamici, che possono influenzare il pH.
Per la maggior parte delle situazioni, la definizione standard di pH è sufficiente.
Come viene misurato il pH
Le misurazioni del pH approssimativo possono essere eseguite utilizzando la cartina di tornasole o un altro tipo di carta pH noto per cambiare i colori attorno a un determinato valore di pH. La maggior parte degli indicatori e delle carte pH sono utili solo per dire se una sostanza è un acido o una base o per identificare il pH in un intervallo ristretto. Un indicatore universale è una miscela di soluzioni di indicatore destinate a fornire una variazione di colore in un intervallo di pH compreso tra 2 e 10.
Misurazioni più accurate vengono eseguite utilizzando gli standard primari per calibrare un elettrodo di vetro e un pHmetro. L'elettrodo funziona misurando la differenza di potenziale tra un elettrodo a idrogeno e un elettrodo standard. Un esempio di elettrodo standard è il cloruro d'argento.
Usi di pH
Il pH è usato nella vita di tutti i giorni così come nella scienza e nell'industria. È usato in cucina (ad es., Reagendo con un lievito in polvere e un acido per far lievitare i prodotti da forno), per progettare cocktail, in detergenti e nella conservazione degli alimenti. È importante nella manutenzione della piscina e nella depurazione delle acque, agricoltura, medicina, chimica, ingegneria, oceanografia, biologia e altre scienze.
