Formule predittive di composti con ioni poliatomici
 Share
Share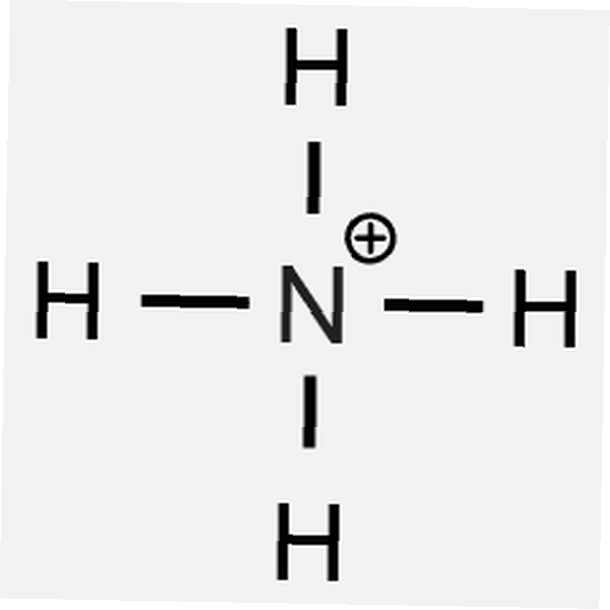
Gli ioni poliatomici sono ioni costituiti da più di un elemento atomico. Questo problema di esempio dimostra come prevedere le formule molecolari di diversi composti che coinvolgono ioni poliatomici.
Problema ione poliatomico
Prevedi le formule di questi composti, che contengono ioni poliatomici:
- idrossido di bario
- fosfato di ammonio
- solfato di potassio
Soluzione
Le formule dei composti contenenti ioni poliatomici si trovano più o meno allo stesso modo delle formule per gli ioni monoatomici. Assicurati di avere familiarità con gli ioni poliatomici più comuni. Ecco un elenco di ioni poliatomici per aiutarti. Guarda le posizioni degli elementi nella tavola periodica. Gli atomi nella stessa colonna l'uno dell'altro (Gruppo) tendono ad esibire caratteristiche simili, incluso il numero di elettroni che gli elementi dovrebbero guadagnare o perdere per assomigliare all'atomo di gas nobile più vicino. Per determinare i composti ionici comuni formati da elementi, tenere presente quanto segue:
- Gli ioni del gruppo I (metalli alcalini) hanno +1 cariche.
- Gli ioni del gruppo 2 (metalli alcalini terrosi) hanno +2 cariche.
- Gli ioni del gruppo 6 (non metalli) hanno -2 cariche.
- Gli ioni (alogenuri) del Gruppo 7 hanno -1 cariche.
- Non esiste un modo semplice per prevedere le cariche dei metalli di transizione. Cerca in una tabella che elenca gli addebiti (valenze) per i possibili valori. Per i corsi di chimica introduttiva e generale, le cariche +1, +2 e +3 sono usate più spesso.
Quando scrivi la formula per un composto ionico, ricorda che lo ione positivo è sempre elencato per primo. Quando ci sono due o più ioni poliatomici in una formula, racchiudere lo ione poliatomico tra parentesi.
Annota le informazioni che hai per le spese degli ioni componenti e bilanciale per rispondere al problema.
- Il bario ha una carica di +2 e quindi l'idrossido ha una carica di -1
1 Ba2+ Lo ione è necessario per bilanciare 2 OH- ioni - L'ammonio ha una carica di +1 e il fosfato ha una carica di -3, quindi
3 NH4+ gli ioni sono tenuti a bilanciare 1 PO43- ione - Il potassio ha una carica di +1 e il solfato ha una carica di -2, quindi
2 K+ gli ioni sono tenuti a bilanciare 1 SO42- ione
Risposta
- Ba (OH)2
- (NH4)3PO4
- K2COSÌ4
Le cariche sopra elencate per gli atomi all'interno dei gruppi sono le cariche comuni, ma dovresti essere consapevole che gli elementi a volte assumono cariche diverse. Vedi la tabella delle valenze degli elementi per un elenco delle cariche che gli elementi sono noti per assumere. Ad esempio, il carbonio assume comunemente uno stato di ossidazione +4 o -4, mentre il rame ha di solito uno stato di ossidazione +1 o +2.
